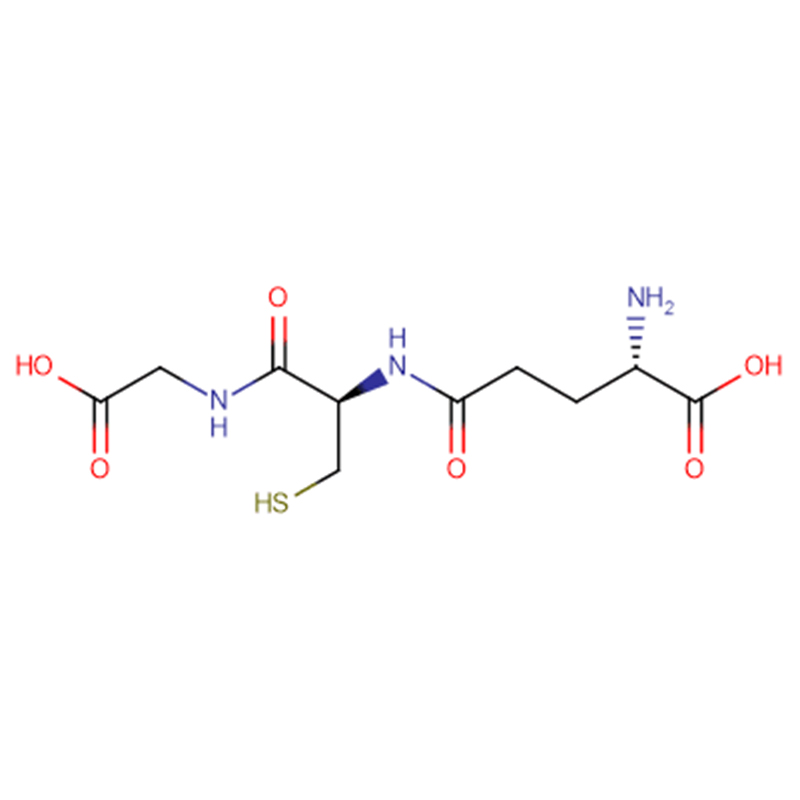
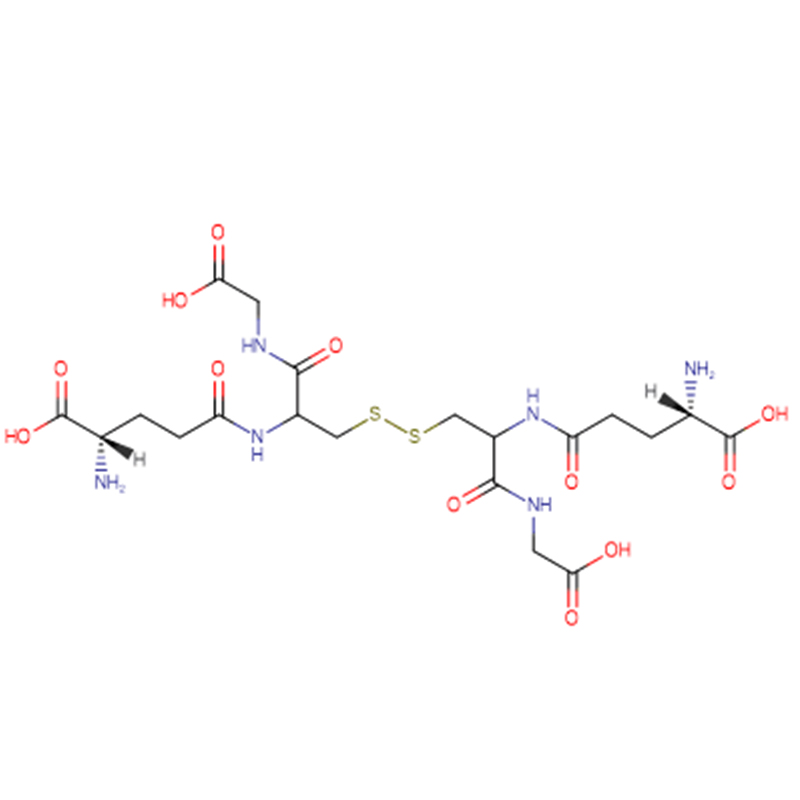
GSH Cas: 70-18-8 98% Bột tinh thể màu trắng
| Số danh mục | XD90227 |
| tên sản phẩm | GSH |
| CAS | 70-18-8 |
| Công thức phân tử | C10H17N3O6S |
| trọng lượng phân tử | 307.323 |
| Chi tiết lưu trữ | 2 đến 8°C |
| Bộ luật thuế quan hài hòa | 29309098 |
Đặc điểm kỹ thuật sản phẩm
| Đặc điểm kỹ thuật sản phẩm | |
| Độ nóng chảy | 185°C |
| Cấp | Cấp dược phẩm |
| Kim loại nặng | tối đa 10ppm |
| thạch tín | tối đa 2ppm |
| Nhận biết | IR : Tương tự với Phổ tham chiếu |
| Tổn thất khi sấy khô | tối đa 0,5% |
| Nhiệt độ bảo quản | +20°C |
| trọng lượng phân tử | 612.63 |
| xét nghiệm | 98,0% tối thiểu |
| Xoay quang học | -15,5°- -17,5 độ |
| Dư lượng đánh lửa | tối đa 0,1% |
| Giải pháp rõ ràng | Rõ ràng và không màu |
| Vẻ bề ngoài | Bột tinh thể trắng |
| chất liên quan | Tổng: tối đa 2,0%, GSSG: tối đa 1,5% |
Protein ORF45 của virus herpesvirus liên quan đến sarcoma Kaposi (KSHV) là một protein tegument sớm đặc hiệu của gammaherpesvirus.Các nghiên cứu trước đây của chúng tôi đã tiết lộ vai trò quan trọng của nó trong cả giai đoạn đầu và giai đoạn cuối của nhiễm trùng KSHV.Trong nghiên cứu này, chúng tôi đã khảo sát sự tương tác của ORF45 bằng cách sử dụng một nhóm các kháng thể đơn dòng.Ngoài các protein kinase (ERK) và p90 ribosome S6 kinase (RSK) được điều hòa ngoại bào đã được xác định trước đó, chúng tôi đã tìm thấy một số protein được đồng hóa khác, bao gồm các protein nổi bật ∼ 38 kDa và ∼ 130 kDa.Phép đo khối phổ cho thấy protein 38-kDa là ORF33 của virus và protein 130-kDa là USP7 của tế bào (protease 7 đặc hiệu của ubiquitin).Chúng tôi đã ánh xạ miền liên kết ORF33 với 19 axit amin ở đầu carboxyl được bảo tồn cao (aa) của ORF45 và miền liên kết USP7 với mô-đun đồng thuận được báo cáo ở vùng trung tâm của ORF45.Sử dụng phương pháp nhuộm miễn dịch huỳnh quang, chúng tôi đã quan sát thấy sự tập trung của ORF45 với ORF33 hoặc USP7 cả dưới các ion điều kiện được truyền và trong các tế bào bị nhiễm KSHV.Hơn nữa, chúng tôi nhận thấy sự tái định vị phụ thuộc ORF45 của một phần ORF33/USP7 từ nhân sang tế bào chất.Chúng tôi thấy rằng ORF45 gây ra sự gia tăng tích lũy protein ORF33 đã bị hủy bỏ nếu miền liên kết ORF33- hoặc USP7 trong ORF45 bị xóa.Hơn nữa, việc xóa đầu cuối carboxyl được bảo tồn của ORF45 trong bộ gen của KSHV đã làm giảm đáng kể mức protein ORF33 trong các tế bào bị nhiễm KSHV và hủy bỏ việc sản xuất virion thế hệ con cháu.Nói chung, kết quả của chúng tôi không chỉ tiết lộ các thành phần mới của bộ tương tác ORF45, mà còn chứng minh rằng sự tương tác giữa các protein này rất quan trọng đối với sự sao chép lylic của KSHV. Virus herpesvirus liên quan đến sarcoma (KSHV) của Kaposi là tác nhân gây ra một số bệnh ung thư ở người.KSHV ORF45 là một protein đa chức năng cần thiết cho quá trình sao chép lylic của KSHV, nhưng cơ chế chính xác mà ORF45 thực hiện các chức năng quan trọng của nó vẫn chưa rõ ràng.Các nghiên cứu trước đây của chúng tôi đã tiết lộ rằng tất cả pr tein ORF45 trong tế bào đều tồn tại ở dạng phức hợp trọng lượng phân tử cao.Do đó, chúng tôi đã tìm cách mô tả đặc điểm tương tác của ORF45 để cung cấp thông tin chi tiết về vai trò của nó trong quá trình sao chép lylic.Sử dụng một nhóm các kháng thể đơn dòng, chúng tôi đã khảo sát hệ tương tác ORF45 trong các tế bào bị nhiễm KSHV.Chúng tôi đã xác định được hai đối tác liên kết mới của ORF45: protein virut ORF33 và protease 7 (USP7) đặc hiệu ubiquitin của tế bào.Chúng tôi tiếp tục chứng minh rằng sự tương tác giữa ORF45 và ORF33 là rất quan trọng để sản xuất hiệu quả các hạt virus KSHV, cho thấy rằng sự can thiệp có mục tiêu với tương tác này có thể là một chiến lược mới để ức chế sự sao chép của KSHV.